Microbiomas polimórficos
La microbiota se asocia simbióticamente con tejidos de barrera en el organismo expuestos al ambiente externo, tales como la epidermis y la mucosa interna (sobre todo el tracto gastrointestinal), la mama, el pulmón y el sistema genitourinario. Los ecosistemas creados por estas bacterias y hongos en el organismo tienen un impacto importante en la salud. Comprender el concepto de disbiosis es fundamental para interpretar el papel de las bacterias en la salud y la enfermedad; la disbiosis intestinal se produce cuando la diversidad de microorganismos beneficiosos que constituyen la microbiota disminuye, alterando de este modo el equilibrio y las funciones de la microbiota.
En el caso del cáncer, parece que la variabilidad polimórfica de los microbiomas entre individuos de una población puede tener un fuerte impacto en los fenotipos cancerosos (ya sean efectos protectores o perjudiciales). El polimorfismo es la existencia de dos o más variantes de una secuencia específica de ADN; está relacionado con la biodiversidad y variación genética dentro de una población. Por tanto, la variabilidad polimórfica se refiere a la presencia de diferentes variantes de un mismo gen (alelo) en una población. El campo que es capaz de estudiar esta variabilidad es la metagenómica.
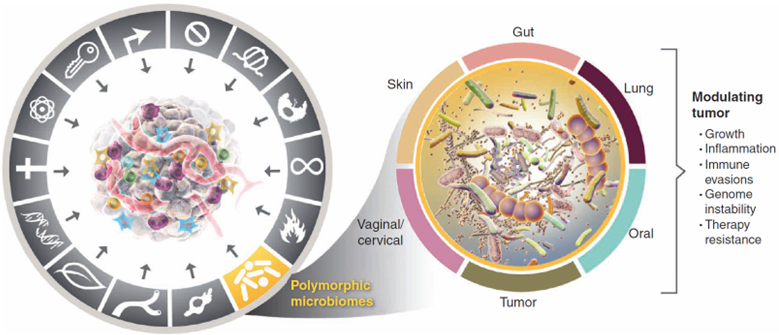
Aún se están estudiando con mayor detenimiento las funciones moduladoras que tendrían los microbiomas promotores de tumores, pero se cree que actúan mediante dos mecanismos generales. Por un lado, está la mutagénesis de los tejidos que aparece por la producción de toxinas bacterianas y otras moléculas que dañan el ADN, bien directamente o bien indirectamente, interrumpiendo los sistemas que mantienen la integridad genómica. Por otro lado, están los efectos que ejerce sobre los sistemas inmunes adaptativos e innatos por distintas vías, incluyendo la producción de factores inmunomoduladores.
Se ha encontrado que las bacterias adheridas a la superficie del epitelio del colon producen moléculas miméticas de ligandos activadores de la proliferación celular, lo cual en las células neoplásicas contribuye a la capacidad de señalización proliferativa característica de las células tumorales. También en el cáncer colorrectal es habitual encontrar bacterias específicas productoras de butirato, un ácido graso de cadena corta capaz de inducir la senescencia celular en las células epiteliales y fibroblásticas. La senescencia es un proceso que inicia la célula como respuesta al estrés o daño, por el cual se detiene la proliferación para evitar la propagación de células dañadas. Aunque han detenido el ciclo celular, permanecen activas metabólicamente hablando por lo que continúan liberando sustancias que, a la larga, pueden ocasionar efectos perjudiciales: inflamaciones, enfermedades relacionadas con la edad (envejecimiento celular), cáncer, etc. Para conocer más sobre la senescencia celular, visita su hallmark.
Las bacterias de la microbiota también pueden producir moléculas inmunomoduladoras que al ser reconocidas por las células inmunes residentes de la mucosa o en el epitelio, activan en ellas la secreción de citocinas y quimiocinas que pasan a la circulación sistémica e intervienen en las respuestas inmunes, ya sea (1) facilitando la tumorigénesis y la progresión maligna o (2) protegiendo al huésped contra estas.
- La disbiosis debilita las uniones estrechas entre las células del epitelio intestinal, con lo que esta barrera física pierde su integridad y permite el transporte de las bacterias y sus productos al hígado (a través de la vena porta). En respuesta, los hepatocitos producen la quimiocina CXCL1, ligando del receptor CXCR2 presente en células mieloides granulocíticas que, una vez activadas, suprimen las células natural killer (NK); entre otras funciones, las NK son las encargadas de identificar y destruir células anormales (como las tumorales), evitando así su proliferación y propagación maligna. Este es un suceso típico de los casos de colangiocarcinoma hepático.
- Las bacterias hidrolizan el peptidoglicano por varios motivos: crecimiento y división bacteriana, y patogenicidad entre otros. En el caso de ciertas cepas de Enterococcus esta hidrolasa recibe el nombre de SagA y su acción libera fragmentos de la pared bacteriana (mucopéptidos) capaces de ser reconocidos por los elementos del sistema inmune innato, a través de los receptores NOD2. Existen estudios que demuestran la implicación de este receptor en la actividad antitumoral, así como en la mejora de la eficacia de la inmunoterapia. Actualmente se están estudiando otras posibles moléculas inmunorreguladoras producidas por más subespecies bacterianas, entre ellas la inosina.
En la terapéutica del cáncer, especialmente en la terapia dirigida y la inmunoterapia, se han hecho avances mediante el uso de bacterias vivas. Gracias a las tecnologías actuales (ingeniería genética básica y bioingeniería sintética sofisticada), se pueden programar las bacterias de forma dirigida para que produzcan y administren agentes anticancerígenos, según las necesidades clínicas. En el siguiente artículo se recogen datos acerca de los posibles beneficios y desafíos de esta opción terapéutica, se explican las interacciones entre el microambiente tumoral y las bacterias que llevan a la regresión del tumor y, además, se proponen métodos para el diseño de bacterias.
Desde hace ya tiempo se reconoce que es posible encontrar bacterias dentro de tumores sólidos de distinto tipo: hueso, cerebro, mama, pulmón, melanoma, ovario, páncreas... Cada tipo de tumor presenta un microbioma característico, pero además, las variaciones polimórficas de los microorganismos están asociadas a las características clinicopatológicas.
Estudios en modelos de ratón con cáncer de pulmón y páncreas, diseñados genéticamente, han demostrado que la presencia de bacterias en las masas tumorales puede promover la inflamación que impulsa la formación del tumor y su progresión maligna. También se ha visto que cuando se eliminan las bacterias mediante el uso de antibióticos, la tumorigénesis disminuye, lo que sugiere que el microbioma del tumor puede contribuir al crecimiento y avance del cáncer.
Hasta muy recientemnte, la microbiota intratumoral se estudiaba a partir del análisis del tejido a granel, de modo que conocer la distribución espacial y el efecto local de la microbiota dentro del tumor no resultaba sencillo. Un estudio publicado en noviembre de 2022 demostró, a través de estudios funcionales y tecnologías de creación de perfiles espaciales in situ, que las bacterias se distribuyen dentro del tumor de una manera organizada y para nada aleatoria. De hecho, forman micronichos con funciones de células inmunitarias y epiteliales que impulsan la progresión maligna.
Para saber más:
- Interacciones bacterianas con el sistema inmunológico intestinal: inmunomodulación. Gastroenterología y hepatología 26, 13-22 (2003).
- Intestinal microbiota: a new force in cancer immunotherapy. Cell Commun Signal 18 (2020).
- Intratumoral bacteria may elicit chemoresistance by metabolizing anticancer agents. Molecular & Cellular Oncology 5 (2018).
- Fecal metabolomic signatures in colorectal adenoma patients are associated with gut microbiota and early events of colorectal cancer pathogenesis. MBio 11 (2020).
- Trasplante fecal de microbiota: aplicaciones presentes y perspectivas futuras. (2020).
- Senescencia e inmunoterapia por inactivación de Stat3 en cáncer. Diss. Instituto de Biología (2019).
Bibliografía empleada para elaborar el texto y las imágenes:
Galeano JL et al. Effect of the intratumoral microbiota on spatial and cellular heterogeneity in cancer. Nature 611, 810-817 (2022).
Hanahan D. Hallmarks of cancer: new dimensions. Cancer Discov 12, 31-46, 2022.
Mai Thi-Quynh D, Qin Y, You SH, Min JJ. Bacteria-cancer interactions: bacteria-based cancer therapy. Experimental & molecular medicine 51, 1-15 (2019).