Invasión tisular y metástasis
Las células de los tumores primarios acaban migrando e invadiendo tejidos adyacentes, y desde allí viajan a sitios distantes donde pueden formar nuevas colonias (metástasis). Las metástasis son la causa del 90 % de las muertes por cáncer en humanos (es decir, la mayoría de las muertes asociadas al cáncer se deben a la enfermedad metastásica y no a los tumores primarios). Las células que desarrollan la metástasis deben ser capaces de abandonar el tumor en el que están, circular por el torrente sanguíneo, soportar la presión de los vasos sanguíneos, adaptarse al nuevo entorno y escapar de las células inmunes. La metástasis puede dividirse en dos fases principales: la diseminación física de las células cancerosas desde el tumor primario hasta tejidos distantes, y la adaptación de dichas células a microambientes tisulares diferentes para llevar a cabo la colonización con éxito. En la fase de diseminación estarían implicados los mecanismos migratorios, mientras que la colonización no está estrictamente acoplada a la diseminación física.
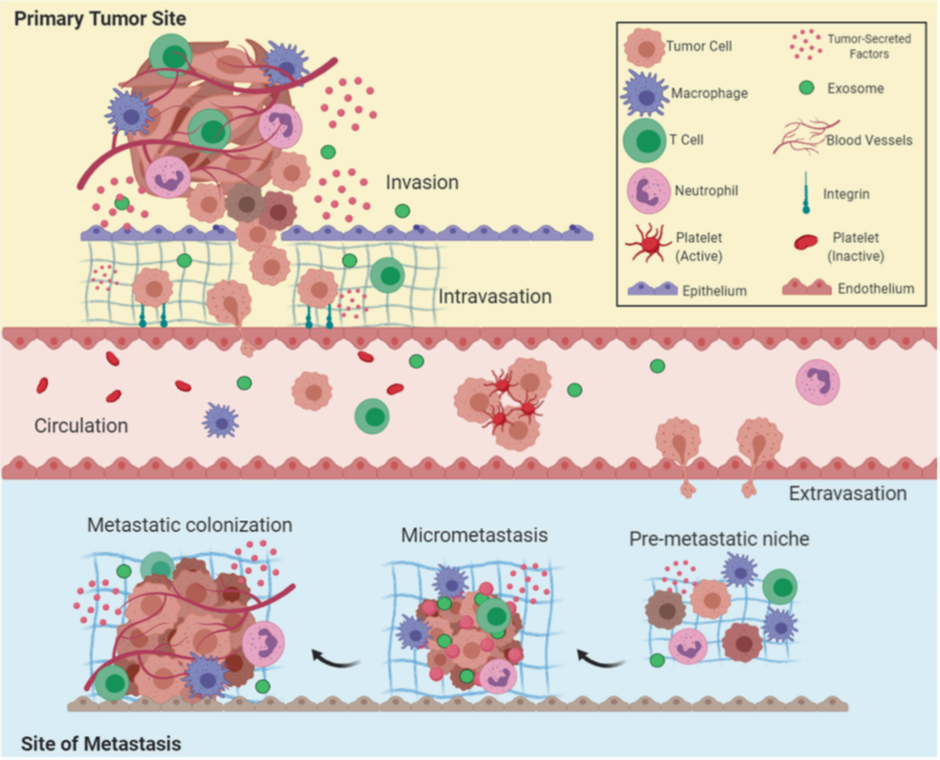
Las células tumorales que adquieren esta capacidad de migrar tienen afectadas moléculas de adhesión célula-célula (CAMs) e integrinas. La alteración más observada es la que afecta a la E-cadherina, expresada ubicuamente en las células epiteliales y que es antagonista de la invasión y la metástasis. En cambio, las moléculas de adhesión asociadas a la migración celular durante la embriogénesis como la N-cadherina están reguladas al alza. Así, se pone de manifiesto el papel del programa regulador del desarrollo conocido como transición epitelio-mesénquima (EMT), que se activa de forma transitoria o estable en diferente grado por las células tumorales durante el curso de la invasión y metástasis. Es importante la plasticidad para revertir la transición y que se dé MET (transición mesénquima-epitelio) para formar nuevas colonias en otros tejidos. De hecho, el proceso de EMT es gradual y parece que un estado intermedio (EMT parcial) tendría mayor eficacia para desarrollar metástasis (más información aquí). Los sitios secundarios a los que llegarían todas estas células no las reciben pasivamente; el microambiente del huésped, denominado nicho premetastásico, es preparado antes del inicio de la metástasis por el tumor primario gracias a distintos factores de secreción y vesículas extracelulares (exosomas).
Otro parámetro implicado en el proceso de invasión son las proteasas extracelulares; los genes que dan lugar a proteasas se ven regulados al alza, mientras que los que inhiben proteasas están regulados a la baja. De este modo es posible alterar la remodelación de la matriz extracelular y conducir a la tumorogénesis. Aquí ganan relevancia las células inflamatorias, que producen estas enzimas además de otros factores (de hecho, las células cancerosas no producirían estas proteasas, sino que liberarían señales quimioatrayentes para reclutar células inflamatorias que sí las produzcan). Por tanto, son importantes las células del estroma tumoral, que estarían implicadas en la adquisición de la capacidad de invasión y metástasis gracias a un crosstalk con las células cancerosas. Para más información sobre la importancia de la inflamación en el cáncer, pincha aquí.
Se está estudiando el papel de más factores en este proceso de invasión.
Por ejemplo, la autofagia parece que también sería importante para iniciar el
avance de ciertos tipos tumorales a metástasis, los nervios presentes en el
microentorno tumoral podrían jugar un papel importante secretando factores como
la doblecortina (una proteína de migración neuronal), etc. En la invasión y la
metástasis también son importantes otros factores relacionados con hallmarks
descritos:
- La expresión genética relacionada con distintos procesos de la metástasis se ve afectada por la homeostasis del oxígeno, ganando relevancia factores de transcripción como HIF (más información aquí), que es capaz de modular el metabolismo de las células. Las diferencias metabólicas entre las células cancerosas llevan a su vez a diferencias en el potencial metastásico; por ejemplo, el transportador de monocarboxilatos MCT1 es importante para lidiar con el estrés oxidativo y es importante para el intercambio de lactato. El lactato tiene un papel muy importante como fuente energética en estas células metastásicas, por lo que la mayoría de ellas tienen altas cantidades de MCT1. Para más información sobre el efecto del metabolismo en el cáncer, pincha aquí.
- La plasticidad epigenética se ha visto cuando la cromatina permisiva induce la expresión de oncogenes que promueven el desarrollo metastásico. Hay más información sobre la reprogramación epigenética aquí.
- El microambiente inmunitario tiene también un papel muy relevante durante la invasión y la metástasis. Por ejemplo, en cáncer colorrectal, en aquellos en los que había metastatizado, la cantidad de células T citotóxicas era más bajo que en los pacientes en los que no había metastatizado. Conocer estos fenómenos es importante para desarrollar inmunoterapias más efectivas (en este caso, aumentar la respuesta de este tipo de células). Las bacterias intratumorales son también capaces de modular el sistema inmune: algunas estimulan la inmunidad antitumoral, otras promueven la inmunosupresión, … Así, el microbioma también afecta a la eficiencia de la inmunoterapia. Para conocer más acerca de la importancia del sistema inmune y del microambiente bacteriano en el cáncer, pincha sobre las palabras en azul.
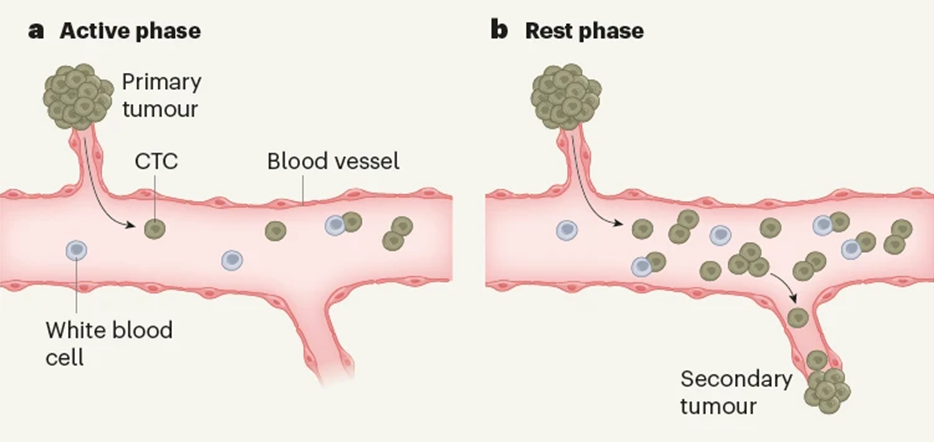
Incluso los ciclos circadianos jugarían un papel importante en este proceso. El reloj circadiano controla una gran cantidad de procesos fisiológicos en el organismo, y disrupciones en los ciclos que controla se han relacionado con el inicio y la progresión tumoral. Recientemente, en un estudio llevado a cabo en cáncer de mama, se vio que la cantidad de intravasaciones de células cancerosas aumentaba durante el sueño (un proceso controlado por el reloj circadiano), y que estas células tenían mayores posibilidad de metastatizar (las células cancerosas circulantes generadas durante la fase activa carecían de capacidad metastásica). Con análisis de ARN se vio cómo se producía una sobrerregulación en ciertos genes únicamente durante la fase de sueño, e incluso se vio que hormonas reguladas circadianamente como la melatonina, la testosterona y los glucocorticoides estaban implicadas en la generación de este tipo de células.
Además de la invasión mesenquimal, de la que se ha hablado hasta ahora, hay dos tipos más de invasión:
- Invasión colectiva: involucra nodos de células cancerosas avanzando en masa a los tejidos adyacentes. Serían responsables de generar colonias de naturaleza policlonal.
- Ameboide: las células cancerosas, individualmente, tienen plasticidad morfológica y pueden deslizarse entre los intersticios de la matriz extracelular.
Una vez dada la invasión y diseminación, es necesario que se produzca la intravasación de las células. Este proceso puede darse de forma pasiva o activa según el tipo tumoral, la vasculatura y el microambiente. Ya en circulación, las células deben ser capaces de sobrevivir. Se ha visto que, cuando forman grupos con células del estroma e inmunes, aumenta su supervivencia. De hecho, las células de carcinoma que pasan a circulación se asocian rápidamente a las plaquetas, pudiendo afectar además al control de la coagulación. Es importante la capacidad de las células cancerosas en circulación de resistir las fuerzas vasculares y la presión mecánica, y también de adherirse a las células del endotelio y extravasarse para colonizar el nicho premetastásico. En órganos con capilares sinusoidales (muy permeables) como el hígado, la extravasación es mucho más sencilla en comparación con otros donde hay barreras más estrechas y láminas basales que requieren de mecanismos más complejos para ser atravesadas. además, las células libres son capaces de circular no solo por los vasos sanguíneos, sino también por los vasos linfáticos, aunque en los nodos linfáticos solo se generarían pequeños depósitos metastásicos.
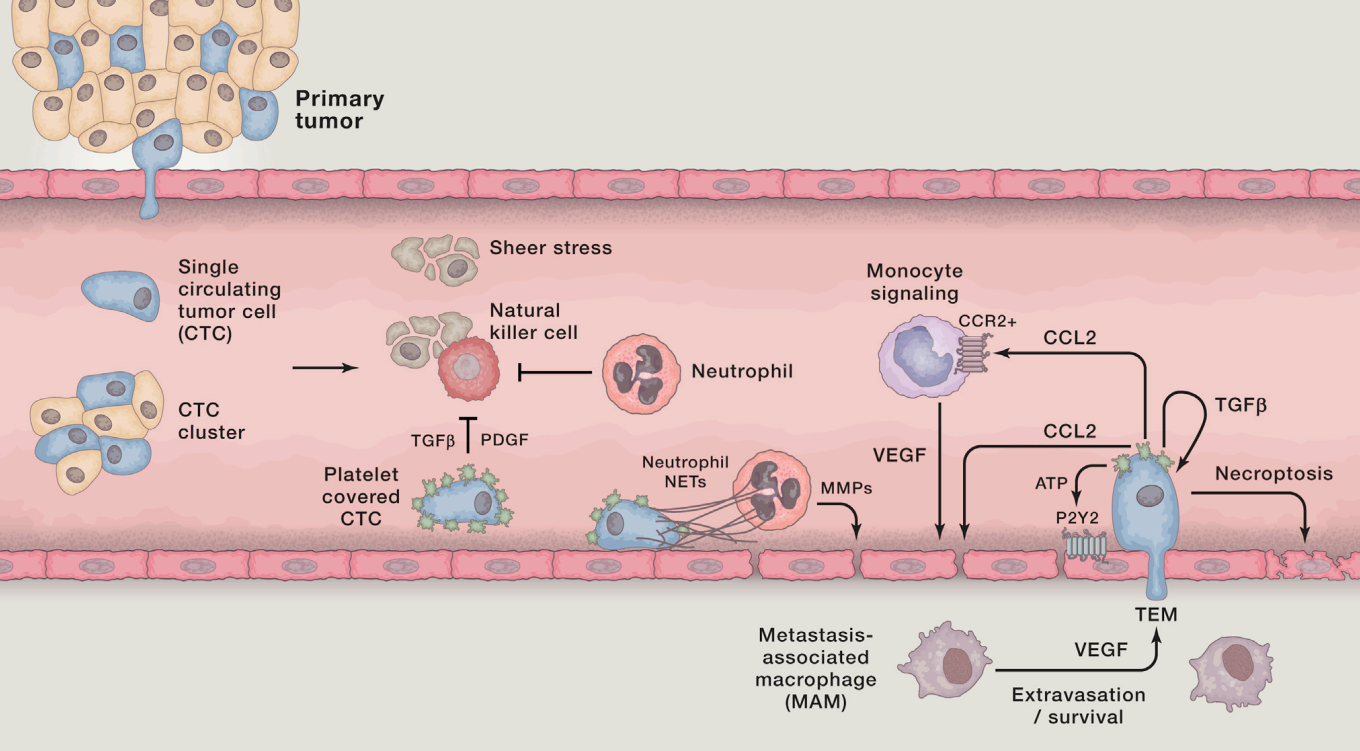
Stephen Paget, en 1889, propuso la hipótesis de la "semilla y tierra" tras observar que la distribución de metástasis en cáncer de mama no era aleatoria; sugirió que las células tumorales (las "semillas") crecían de forma preferencial en microambientes específicos (la "tierra"), y que la metástasis tenía lugar solo cuando las semillas se implantaban en un suelo adecuado. Este organotropismo ha sido confirmado posteriormente al desvelarse la base genética de la colonización en diferentes órganos. Un ejemplo es la alta frecuencia de metástasis en el hueso en el cáncer de mama, en la que se ha identificado al flujo de calcio como un mecanismo de crosstalk entre el nicho osteogénico y las células cancerosas. Aun así, en algunos casos, la especificidad viene dada también por otros factores como el propio diseño del sistema circulatorio. Un ejemplo es cómo en el carcinoma colorrectal se favorece mucho la metástasis en el hígado por el drenaje de la vena porta hepática.
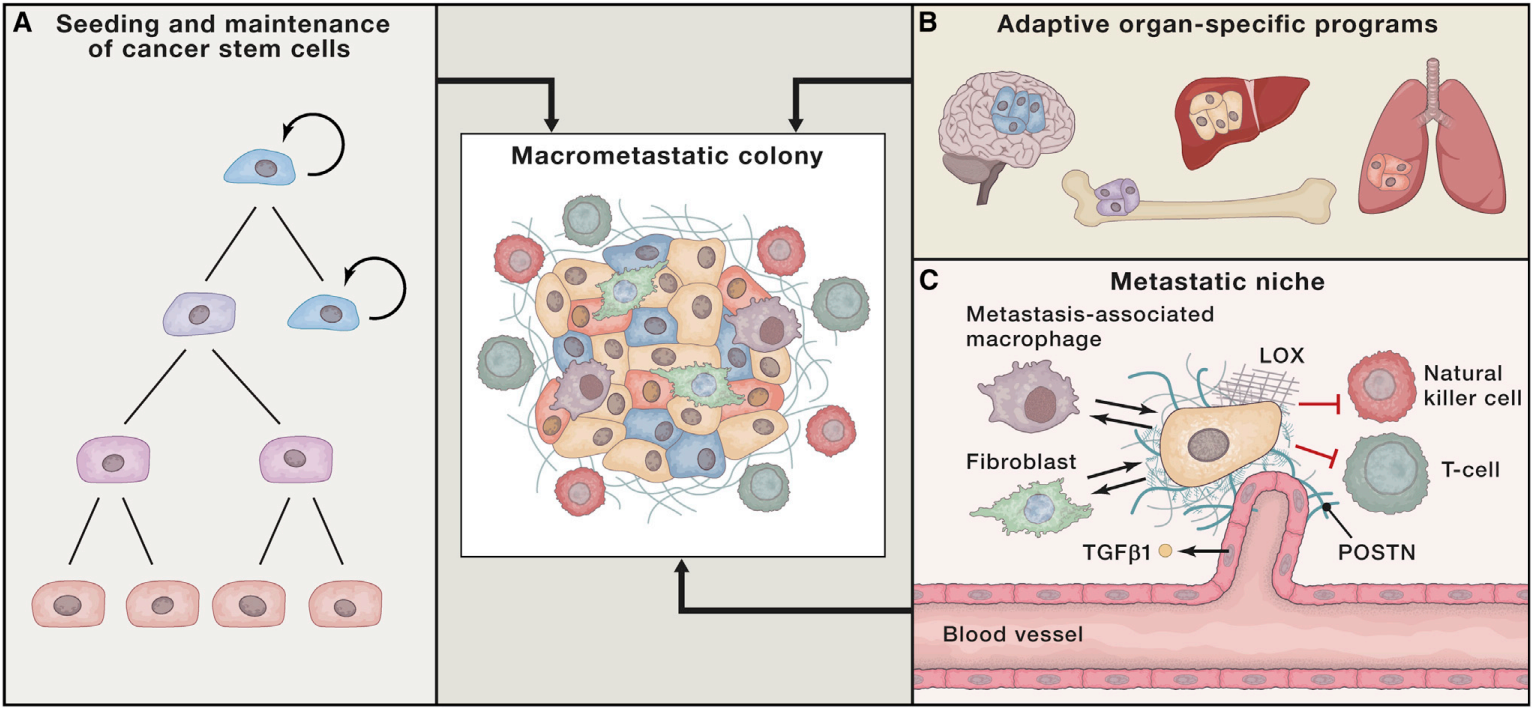
Durante la colonización de las células metastásicas se ha visto que los exosomas también juegan un papel importante, al igual que las interacciones con las células del tejido que se está colonizando. La aclimatación puede prolongarse mucho en el tiempo, quedando las metástasis incluso en estado de dormancia. Este estado se da cuando la tasa de proliferación es igual a la de apoptosis, manteniéndose un balance que puede alcanzarse por señales supresoras, restricción de la angiogénesis o por la acción del microambiente inmune. En algunos tipos de cáncer, el tumor primario incluso es capaz de liberar señales supresoras de tumores al resto del organismo y mantener micrometástasis dormidas; si se elimina el tumor, estas pueden resurgir. En otros casos (como en el cáncer de mama o en melanomas), metástasis macroscópicas pueden aparecer años después de eliminar el tumor primario, habiéndose dado la colonización tras mucho tiempo de "ensayo y error". Se ha formulado también la idea de que estas células durmientes estarían en nichos reservados para poblaciones de células madre. Por ejemplo, en metástasis en el hueso de células de cáncer de próstata, estas compiten con las células madre hematopoyéticas por ocupar su nicho. Se ha visto incluso cómo células que emigraron del tumor primario son capaces de volver a él (migración reversa) y generar fenotipos y programas de expresión génica distintos a los presentes en este tumor.
Por tanto, para que la colonización metastásica tenga éxito, parece que es necesaria la capacidad de "germinar" y mantener una población de células madre cancerosas capaces de iniciar un tumor, la capacidad de ingeniar programas de colonización específicos de órganos, y el desarrollo de un nicho capaz de dar soporte al tumor:
El diseño de las diferentes terapias frente a la metástasis debe tener en cuenta las diferencias genéticas y fenotípicas presentes en los distintos tipos. Actuar sobre la colonización y las células en estado de dormancia parece la estrategia más adecuada, aunque hay considerar otras aproximaciones. Se está planteando actuar sobre la alta plasticidad para evitar resistencia a los tratamientos, en la que estarían implicados factores moleculares como L1CAM o CD36; actuar sobre la dormancia, ya sea eliminando a este tipo de células o impidiendo su reactivación; actuar sobre el microbioma, … También se están generando organoides derivados de los pacientes de cáncer en los que se puede comprobar su sensibilidad a los medicamentos, aunque se pierde el microambiente tumoral (esto se está intentando solventar creando sistemas más complejos).
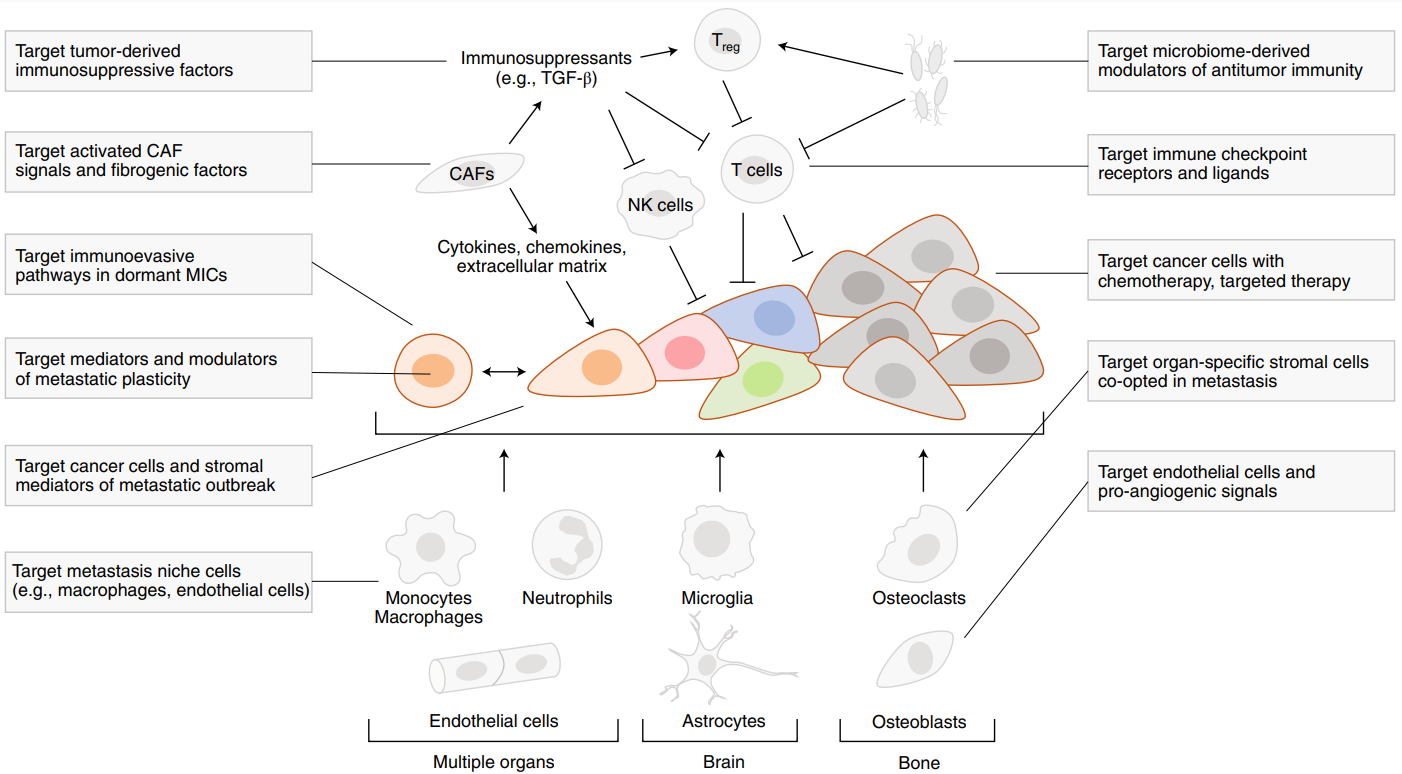
Los mecanismos de resistencia a tratamientos de las células metastásicas pueden ser muy parecidos a los de las células del tumor primario, pero también aparecen mecanismos de resistencia particulares del lugar de diseminación de las células. Una hipótesis es que el microambiente metastásico favorezca ciertos programas biológicos que confieran resistencia a estas células tumorales. Por otro lado, otra hipótesis dice que las células de la metástasis no serían ni más ni menos resistentes que las células del tumor primario.
Para saber más:
- Genomic control of metastasis. Br J Cancer 124, 3–12 (2021).
- Emerging strategies for treating metastasis. Nat Cancer 2, 258-270 (2021).
- Towards targeting of shared mechanisms of cancer metastasis and therapy resistance. Nat Rev Cancer 22, 157–173 (2022).
- Classical epithelial-mesenchymal transition (EMT) and alternative cell death process-driven blebbishield metastatic-witch (BMW) pathways to cancer metastasis. Sig Transduct Target Ther 7, 296 (2022).
Bibliografía empleada para elaborar el texto y las imágenes:
Ball H, Nagrath S. Cancer cells spread aggressively during sleep. Nature 607, 33–34 (2022).
Diamantopoulou Z, Castro-Giner F, Schwab FD et al. The metastatic spread of breast cancer accelerates during sleep. Nature 607, 156–162 (2022).
Fares J, Fares MY, Khachfe HH et al. Molecular principles of metastasis: a hallmark of cancer revisited. Sig Transduct Target Ther 5, 28 (2020).
Ganesh K, Massagué J. Targeting metastatic cancer. Nat Med 27, 34-44 (2021).
Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 100, 57-70 (2000).
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 144, 646-674 (2011).
Lambert AW, Pttabiraman DR, Weinberg RA. Emerging biological principles of metastasis. Cell 168, 670-691 (2017).
Langley RR, Fidler IJ. The seed and soil hypothesis revisited—The role of tumor-stroma interactions in metastasis to different organs. Int. J. Cancer, 128: 2527-2535 (2011).