Inestabilidad genómica y mutación
Todas las capacidades se adquieren de forma directa o indirecta por cambios en el genoma de las células cancerosas. Las mutaciones son una fuente de diversidad genética y selección natural, favoreciendo la evolución, pero la inestabilidad genética, entendida como una tasa de mutación superior a la normal, puede ser perjudicial y capaz de acabar produciendo cáncer. En la célula hay mecanismos que aseguran que las mutaciones sean eventos poco frecuentes, por lo que fallos en ellos aumentan la mutabilidad del genoma hasta hacerla perjudicial. Los defectos en este tipo de genes están relacionados con fallos en la detección del daño del ADN y la activación de la maquinaria de reparación, con problemas al reparar el ADN directamente o con la incapacidad de inactivar o interceptar moléculas mutagénicas. La mutabilidad no solo se alcanza con estos fallos en la maquinaria de mantenimiento del genoma, sino también por un aumento en la sensibilidad a agentes mutagénicos (o por ambos). Esta inestabilidad genómica puede iniciar el cáncer, aumentar su progresión e influir en el pronóstico del paciente que lo tenga.
Hay varias formas de inestabilidad genómica:
Inestabilidad cromosómica (CIN): hay una alta tasa de cambio en la estructura y el número de los cromosomas en comparación con las células normales. Es el principal fenómeno de inestabilidad genómica en los tumores.
Inestabilidad de microsatélites (MSI o MIN): el número de repeticiones en las secuencias de microsatélites aumenta o disminuye.
Aumento en la frecuencia de mutaciones de pares de bases.
Los cánceres pueden ser hereditarios o esporádicos (no hereditarios). En los hereditarios hay tanto CIN como MSI y mutaciones de pares de bases, y todas estas formas de inestabilidad genómica están relacionadas con mutaciones en los genes de reparación del ADN. Un ejemplo son las mutaciones en el gen MUTYH (o MYH), que codifica una ADN glicosilasa relacionada con la reparación de escisión de bases; al estar mutada, aumenta la frecuencia de transversiones (las guaninas y citosinas pasan a timinas y adeninas). La presencia de inestabilidad cromosómica está relacionada con mutaciones en genes de reparación como BRCA1, BRCA2, RECQL4, BLM, y otros. El ADN se replica con muchísima fidelidad, pero puede sufrir daños por exposición a agentes mutagénicos (como agentes químicos, radiación ultravioleta o ionizante, …), eventos espontáneos o fallos durante el proceso de replicación; para mantener la integridad son necesarios estos mecanismos de reparación, de ahí que fallos en ellos hagan más propensa la aparición del cáncer.
La hipótesis del mutador dice que la inestabilidad genómica proviene de un aumento en la tasa de mutación espontánea por defectos en este tipo de genes. Estarían presentes en todas las células, pero en algunas se produciría un evento de mutación que desencadenaría esta inestabilidad y conduciría al desarrollo de un tumor. Los genes que se verían afectados serían genes guardianes (caretaker genes), relacionados con la reparación del ADN y el control de los checkpoints de la mitosis. Los genes guardianes clásicos son TP53, que codifica para p53 y promueve la apoptosis en la célula cuando detecta que el daño en el ADN es excesivo (se conoce como el "guardián del genoma"), y el gen ATM (proteína mutada de la ataxia telangiectasia), que codifica una serín/treonín quinasa de la familia PI3K que responde al daño del ADN fosforilando sustratos clave implicados en la reparación de este ADN y en el control del ciclo celular. Estos dos genes, a diferencia de otros genes guardianes, están sujetos a una presión selectiva en el cáncer por ser inactivados (o ganar acción pro-oncogénica como en TP53, sobre lo que puedes encontrar más información aquí).
En cuanto a los cánceres que no son hereditarios, también se podrían explicar con un modelo de estrés de replicación del ADN inducido por oncogenes: la inestabilidad cromosómica provendría de un colapso en las horquillas de replicación del ADN inducida por oncogenes, llevando a roturas de doble hebra y, así, a la inestabilidad genómica. Hay sitios específicos del genoma que son especialmente sensibles al estrés replicativo, y son los que estarían más frecuentemente afectados cuando hay inestabilidad genómica.
Es importante considerar el papel del acortamiento de los telómeros (explicado en mayor profundidad aquí), ya que las células que los tienen muy acortados están en mayor riesgo de sufrir CIN. En la mayoría de los casos se induce apoptosis o senescencia, pero en unos pocos este proceso falla y las células continúan replicándose. También puede haber anormalidades en el centrosoma que conduzcan a problemas en el reparto cromosómico y aneuploidías, produciendo así inestabilidad genómica.
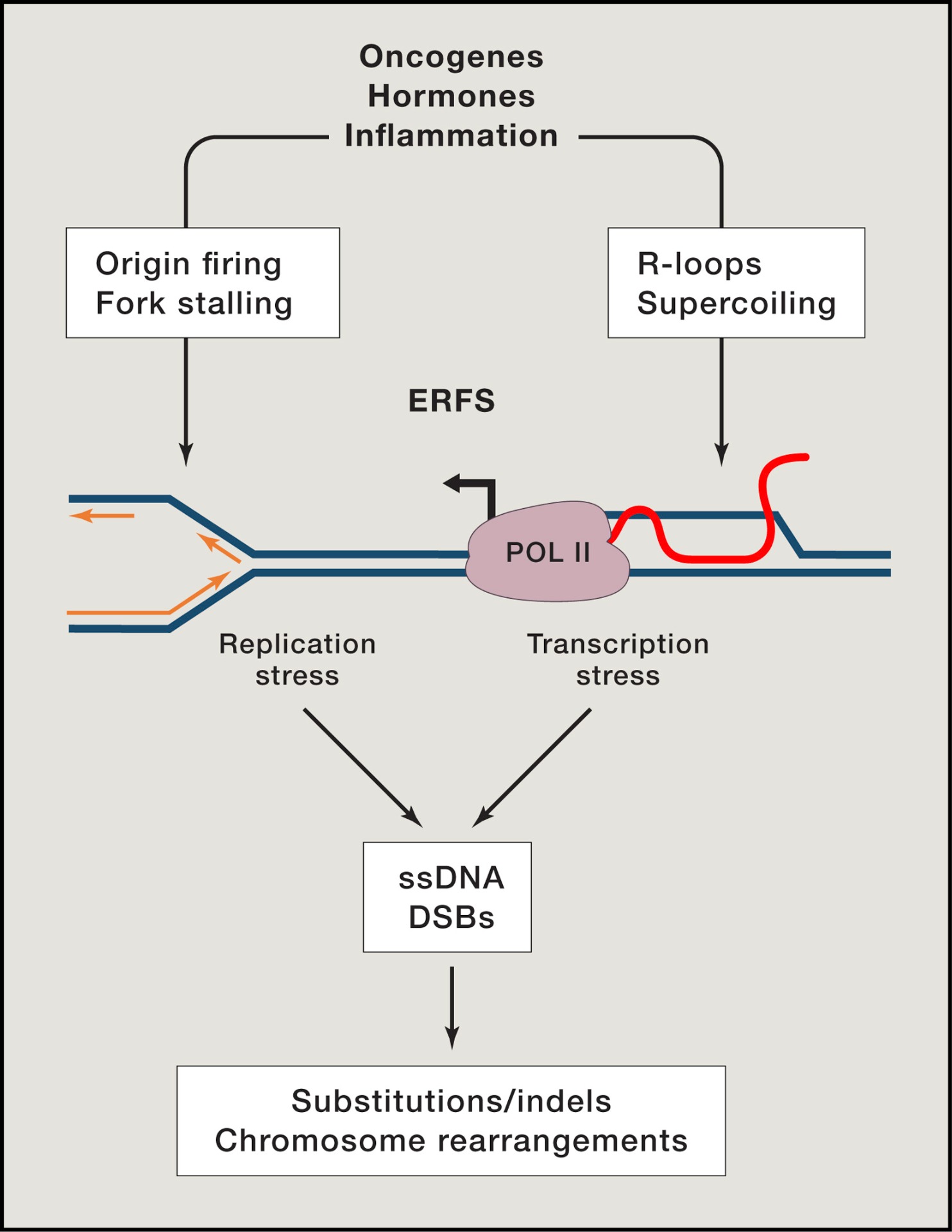
Por tanto, el panorama mutacional del cáncer se genera a través de una combinación de estrés ambiental y endógeno que provocan sustituciones de bases, inserciones, deleciones y reordenamientos cromosómicos. Recientemente, se ha visto que incluso las células con suficiente capacidad de reparación pueden ser perjudicadas por este estrés endógeno y oncogénico por sobrecarga de las vías normales del mantenimiento del genoma. Los oncogenes, las hormonas y la inflamación pueden promover la activación no programada de los mecanismos de replicación y transcripción; esto puede ocasionar estrés replicativo y transcripcional a través de mecanismos que son en gran parte desconocidos. A partir de estrés, se pueden generar ssDNA y DSB (roturas de doble cadena del DNA) en ERFS (sitios frágiles de replicación temprana), provocando inestabilidad genómica.
Se han ido buscando tratamientos que hagan frente a la inestabilidad genómica. Algunas aproximaciones son:
Tratamientos dirigidos a las vías de reparación del ADN.
Tratamientos dirigidos a la inestabilidad de los microsatélites.
Tratamientos dirigidos a la expresión génica de los componentes del ciclo celular.
Tratamientos dirigidos a las anormalidades en el centrosoma.
Para saber más:
- Jeggo, P., Pearl, L. & Carr, A. DNA repair, genome stability and cancer: a historical perspective. Nat Rev Cancer 16, 35–42 (2016).
- Löbrich, M., Jeggo, P. The impact of a negligent G2/M checkpoint on genomic instability and cancer induction. Nat Rev Cancer 7, 861–869 (2007).
Bibliografía empleada para elaborar el texto y las imágenes:
Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 100, 57-70 (2000).
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 144, 646-674 (2011).
Lynnette R. Genomic instability in human cancer: Molecular insights and opportunities for therapeutic attack and prevention through diet and nutrition. Seminars in cancer biology. Academic Press 35, S5-S24 (2015).
Negrini, S., Gorgoulis, V. & Halazonetis, T. Genomic instability — an evolving hallmark of cancer. Nat Rev Mol Cell Biol 11, 220–228 (2010).
Tubbs, A., Nussenzweig, A. Endogenous DNA damage as a source of genomic instability in cancer. Cell, 168(4), 644-656 (2017).