Evadir la apoptosis
La muerte celular programada (apoptosis) permite restringir el número de células, por lo que los tumores deben adquirir resistencia frente a este mecanismo. En la apoptosis se produce la disrupción de la membrana celular, la rotura del "esqueleto" nuclear y citoplasmático, la degradación de los cromosomas la fragmentación del núcleo, etc. El término apoptosis deriva del griego y hace referencia a la caída de las hojas de los árboles en otoño. La posibilidad de que esta sirva como una barrera contra el cáncer se planteó por primera vez en 1972, cuando Kerr, Wyllie y Currie describieron la apoptosis masiva en las células que pueblan tumores dependientes de hormonas de crecimiento rápido después de la abstinencia de dichas hormonas. El descubrimiento del oncogén Bcl-2 y su reconocimiento por tener actividad antiapoptótica abrió la investigación de la apoptosis en el cáncer a nivel molecular.
La maquinaria de apoptosis se divide en dos componentes: los sensores (reguladores, en upstream) y los efectores (en downstream). Los sensores se encargan de monitorizar el entorno extracelular (programa extrínseco) e intracelular (programa intrínseco) para detectar posibles anormalidades; estas señales regulan los efectores de la muerte celular, muchos de los cuales están en las mitocondrias. Los efectores finales son las caspasas, que ejecutan el programa de muerte celular. En esta familia de cisteín proteasas están las caspasas iniciadoras (como las caspasa-2, caspasa-8, caspasa-9 o caspasa-10), que se activan por estos estímulos apoptóticos, y las caspasas ejecutoras (como las caspasa-3 y caspasa-7), que se activan por las caspasas iniciadoras y llevan a cabo la escisión proteolítica de sustratos celulares concretos para desencadenar la muerte celular.
Hay dos rutas para llevar a cabo la apoptosis: la vía extrínseca y la vía intrínseca:
- Vía extrínseca: las caspasas-8 y caspasa-10 (iniciadoras) se activan por la formación de un complejo de señalización inductor de muerte (DISC) en respuesta a ligandos extracelulares como Fas o TNF (factor de necrosis tumoral) que se unen a receptores de membrana en la superficie de la célula.
- Vía intrínseca: se produce una permeabilización de la membrana mitocondrial externa (MOMP) que permite la liberación de factores proapoptóticos al citosol. Entre ellas están el citocromo c y SMAC, que provienen del espacio intermembrana de la mitocondria. En el citoplasma, el citocromo c se une a la proteína adaptadora Apaf-1 para formar un complejo activador de la caspasa-9 llamado apoptosoma. SMAC aumenta la capacidad activadora de caspasas del citocromo c y es capaz de neutralizar una proteína inhibidora de las caspasas 3, 7 y 9, XIAP. La iniciación de la permeabilización de la membrana mitocondrial externa viene determinada por la familia de proteínas BCL-2, entre las que se incluyen BIM, BID, BAD, PUMA, NOXA, BMF, BAX, BAK, … Cuando hay estrés genotóxico o citotóxico, algunas como BIM, BID o BAD se activan y promueven la oligomerización de BAX o BAK, resultando en MOMP. Otras proteínas de la misma familia como BCL-xL o MCL-1 hacen de contrapeso y secuestran proteínas proapoptóticas.
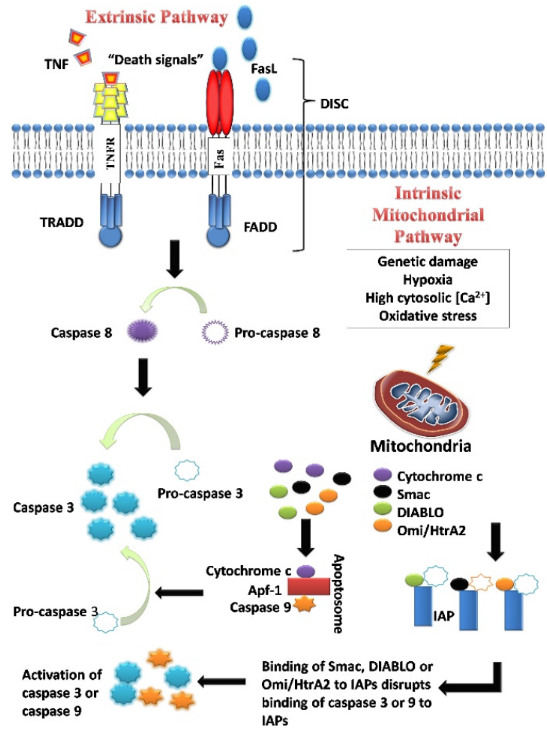
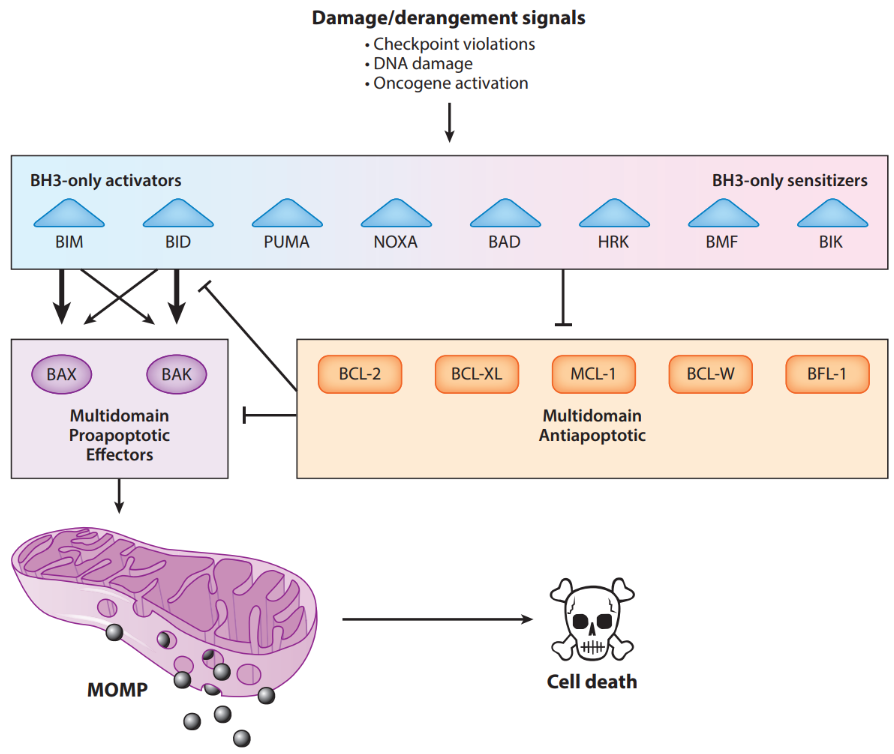
Tanto la vía extrínseca como la vía intrínseca convergen en la caspasa-3. Esta elimina un inhibidor de la ADNasa activada por caspasa, que es responsable de la apoptosis del núcleo celular. Además, las otras caspasas inducen la rotura de proteínas quinasas, del citoesqueleto, de reparación del ADN, etc. Esto afecta al citoesqueleto, el ciclo celular y a las vías de señalización, contribuyendo a los cambios morfológicos característicos de la apoptosis.
Las células tumorales están bajo estrés constante (hipoxia, inestabilidad genómica, …). Estos son estímulos apoptóticos que activarían la vía intrínseca, pero las células carcinogénicas son capaces de evadir esta respuesta esquivando las vías apoptóticas. En algunos casos aumenta la expresión de genes antiapoptóticos o desciende la de genes proapoptóticos, y en otros casos se inhibe la apoptosis mediante mecanismos de estabilización de las proteínas antiapoptóticas o de desestabilización de las antiapoptóticas. Incluso, es posible cambiar las funciones de estas proteínas por modificaciones postraduccionales como la fosforilación. Por tanto, las células cancerosas pueden modular las vías transcripcional, traduccional y postraduccionalmente.
Es común que se produzca un desequilibrio entre las proteínas
antiapoptóticas y proapoptóticas en las células tumorales. Componentes de la
familia de proteínas BCL-2 suelen verse afectados, resultando en un
desequilibrio en la apoptosis. Otro caso es el del factor de supresión tumoral
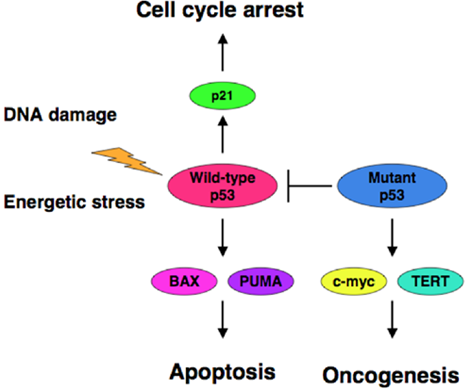
p53, que forma parte del circuito de señalización de la apoptosis (se conoce
como el "guardián del genoma"). Mutaciones de ganancia de función oncogénica (o
también de inactivación) conducen a un crecimiento rápido de los tumores con
pocas células apoptóticas. Las mutaciones en p53 están presentes en más del 50
% de los cánceres humanos. Para conocer más sobre p53, visita el hallmark de la insensibilidad a las señales antiproliferativas.
Los inhibidores de proteínas apoptóticas (IAP) son un grupo de proteínas similares tanto funcional como estructuralmente que regulan la apoptosis, la citocinesis y la transducción de señales. Algunas de ellas son XIAP (BIRC4), NAIP (BIRC1), c-IAP1 (BIRC2), c-IAP2 (BIRC3), etc. Son inhibidores endógenos de las caspasas, promoviendo su inactivación y degradación. La expresión desregulada de estas proteínas está presente en muchos tipos de cáncer; por ejemplo, la expresión anómala de IAP en células de cáncer de páncreas es responsable de la resistencia a quimioterapia (correlacionaba sobre todo con c-IAP2). También en muchos tipos de tumores puede verse reducida la propia actividad de las caspasas. En otros casos se ha visto una disfunción en la señalización de los receptores de muerte, implicados en la vía extrínseca de la apoptosis.
Las estrategias terapéuticas relacionadas con este aspecto buscan reestablecer la señalización apoptótica, eliminando así células cancerosas. Algunas tienen como diana proteínas de la familia BCL-2; por ejemplo, ABT-737 inhibe proteínas antiapoptóticas como BCL-2, BCL-xL o BCL-w. También se han usado siRNA para inhibir la expresión de este tipo de proteínas directamente. Se han buscado terapias que tengan como diana a p53, ya sea devolviéndole su función normal, eliminando el mutante, activándolo (en caso de haber quedado inactivo), etc. Entre las IAP, la proteína XIAP es el inhibidor más potente de la apoptosis, por lo que la mayoría de terapias dirigidas frente a estos inhibidores se han desarrollado contra XIAP. También se ha buscado activar de forma sintética a las caspasas; un ejemplo es la apoptina, una pequeña proteína que proviene del virus de la anemia de pollo y es extremadamente específica de las células cancerígenas, aunque tiene una fuerte tendencia a oligomerizar y se reduce su capacidad de entrar a las células.
Además de todo lo anterior, hay que considerar que, aunque las células tumorales son capaces de seleccionar la evasión de la apoptosis bajo el estrés de la oncogénesis, no pueden seleccionar la resistencia a las señales apoptóticas que aún no han encontrado, como las provocadas por la quimioterapia.
En contraste con la apoptosis, la necrosis disemina los restos celulares en el microambiente tisular local. Algunas moléculas son señales proinflamatorias, pudiendo reclutar células del sistema inmune al tejido. Algunas células inflamatorias pueden ser promotoras de tumores.
Para saber más:
- Targeting apoptosis in cancer therapy. Nat Rev Clin Oncol 17, 395–417 (2020).
- The Roles of Therapy-Induced Autophagy and Necrosis in Cancer Treatment. Clin Cancer Res 13, 24, 7271–7279 (2017).
Bibliografía empleada para elaborar el texto y las imágenes:
Fernald K, Kurokawa, M. Evading apoptosis in cancer. Trends in cell biology 23, 12, 620-633 (2013).
Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 100, 57-70 (2000).
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 144, 646-674 (2011).
Letai A. Apoptosis and cancer. Annual Review of Cancer Biology 1, 275-294 (2017).
Wong RS. Apoptosis in cancer: from pathogenesis to treatment. J Exp Clin Cancer Res 30, 87 (2011).