Células senescentes
La senescencia celular es un estado irreversible de detención proliferativa que las células utilizan como mecanismo protector para mantener la homeostasis dentro del tejido, y es posiblemente un mecanismo complementario a la muerte celular programada. Este estado no solo detiene el ciclo de división celular, sino que además provoca cambios en la morfología y el metabolismo celular, dando lugar a un fenotipo secretor asociado a la senescencia (SASP). Cuando adoptan este fenotipo, las células secretan proteínas bioactivas como quimiocinas, citoquinas y proteasas que serán distintas dependiendo de la célula que entre en senescencia (tipo de célula y tejido donde se encuentren).
El estado de senescencia es inducido por distintos motivos como pueden ser el daño al ADN, falta de nutrientes, daño en los orgánulos, afectaciones a redes de señalización celular, etc.
La senescencia celular se observó como un mecanismo de protección contra la neoplasia donde las células cancerosas eran inducidas al estado de senescencia y, por tanto, detenían su ciclo de división, evitando la proliferación y malignidad del tumor. Sin embargo, se ha visto recientemente que este estado de senescencia en ciertos contextos podría estar haciendo justo lo contrario (permitiría el avance del tumor). Es más, en un estudio con roedores a los que se habían eliminado las células senescentes, se observó que en dichos roedores se retrasaban algunos síntomas relacionados con la edad y se redujo la incidencia de tumorigénesis espontánea y muerte asociada al cáncer.
La forma en la que esta senescencia podría ayudar a un avance del tumor se piensa que es por el fenotipo SASP, que es capaz de trasmitir a las células cercanas moléculas de señalización que contribuirían en las células tumorales a aumentar algunas de las características del cáncer como son la inducción de angiogénesis, la evasión de la apoptosis, metástasis, etc.
Además, las células cancerosas que entran en estado de senescencia lo hacen en periodos transitorios, es decir, es reversible para ellas. Se piensa que esta característica se origina por la resistencia a la terapia (la cual en la mayoría de los casos se trata de atacar células con alta proliferación).
Asimismo, se ha demostrado que los fibroblastos senescentes que se forman por envejecimiento natural o por agresiones ambientales remodelan la zona generando un microambiente apto para la invasión local de un tumor, por ejemplo, proveniente de metástasis. Esto se debería de nuevo a las moléculas que secreta al modificar su fenotipo siendo SASP. A su vez reclutan células del sistema inmune que ayudan a aumentar la inmunosupresión.
Este sistema apoyaría al concepto actual de que los tumores se componen de células cancerosas pero que interactúan con el microambiente y reclutan a células accesorias (estromales) para beneficiarse de ellas. Su estudio es esencial para comprender la resistencia a algunas terapias y para investigar sobre posibles soluciones a la misma.
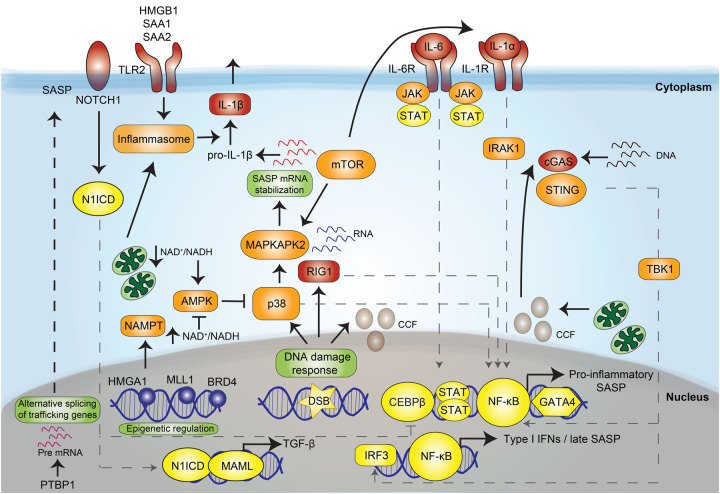
Se ha descubierto que la senescencia está relacionada con el envejecimiento del organismo al disminuir los síntomas de envejecimiento en ratones donde se elimina la senescencia. Sin embargo, se ha visto que también funciona como anticancerígeno. Esto se conoce como pleiotropía antagónica, donde la senescencia previene el crecimiento del tumor y evita así su avance. Cuando hay senescencia en exceso, todos los factores secretados por el fenotipo SASP generan una inflamación crónica que favorece la formación de tumores (hallmark inflamación).
Esta idea está apoyada por la idea evolutiva de favorecer la estabilidad en la vida joven y no al final de la misma. Se piensa que una de las consecuencias de alto nivel de senescencia con la edad es debido a una disminución del correcto funcionamiento del sistema inmune que, de forma habitual, elimina algunas células en senescencia evitando su acumulación (hallmark inmune).
Con esta idea se plantea como terapia el refuerzo del sistema inmune o la eliminación mediante terapia de las células senescentes, aunque no en su totalidad (ya que poseen otras funciones como la cicatrización de heridas o la reparación de tejidos). Sin embargo, aún no se conoce a ciencia cierta el motivo del aumento de estas células senescentes, y son necesarios más experimentos al respecto antes de comenzar con una terapia basado en ello.
Para saber más:
- Mechanisms and functions of cellular senescence. The Journal of clinical investigation 128, 4 (2018).
- The dynamic nature of senescence in cancer. Nature cell biology 21, 1 (2019).
- Cancer Stem Cells-Origins and Biomarkers: Perspectives for Targeted Personalized Therapies. Frontiers in immunology 11, 1280 (2020)
- Senescent Cells in Cancer Therapy: Friends or Foes? Trends in cancer 6, 10 (2020).
Bibliografía empleada para elaborar el texto y las imágenes:
Birch J, Gil J. Senescence and the SASP: many therapeutic avenues. Genes & development 34, 23-24 (2020).
Hanahan D. Hallmarks of cancer: new dimensions. Cancer Discov 12, 31-46 (2022).
Kowald A et al. On the evolution of cellular senescence. Aging cell 19, 12 (2020).