Autosuficiencia en las señales de crecimiento
Las células normales requieren de señales de crecimiento mitogénico antes de pasar de un estado quiescente a uno activo proliferativamente. Estas señales se pasan a la célula a través de receptores transmembranales que unen distintas moléculas señalizadoras: factores de crecimiento, moléculas de la matriz extracelular y moléculas de interacción célula-célula. Se sabe que las células normales necesitan mitógenos para proliferar, pero las células tumorales muestran una reducida dependencia por estos factores de crecimiento exógeno. Muchos oncogenes actúan imitando estas señales de crecimiento. Así, las células tumorales producirían sus propios factores de crecimiento, a los que responden ellas mismas creando un feedback positivo conocido como autoestimulación, reduciendo su dependencia a la estimulación exógena.
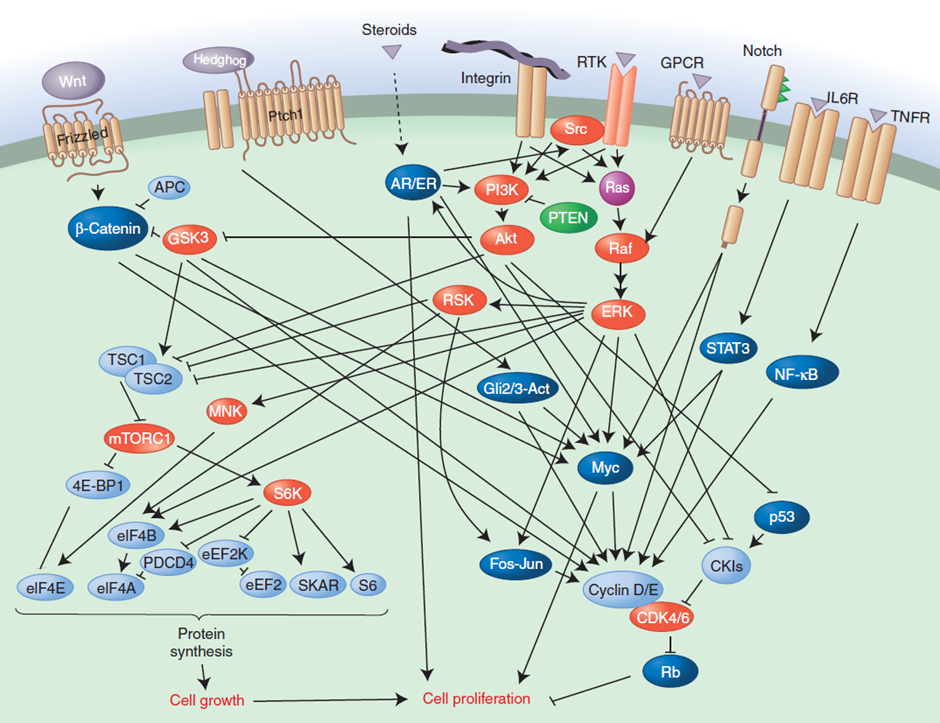
Hay tres estrategias moleculares comunes para lograr esta autonomía: la alteración de las señales de crecimiento extracelulares, la alteración de los transductores transcelulares de dichas señales y la alteración de los circuitos intracelulares que convierten la señalización en acción.
Los receptores de factores de crecimiento suelen tener actividad tirosín quinasa en su dominio citoplasmático. En muchos tipos de cáncer, estos receptores están sobreexpresados, siendo hiperestimulados en un ambiente en el que el factor de crecimiento al que responden está en suficiente cantidad (en una en la que antes no generasen esa respuesta proliferativa). Incluso puede haber señalización independiente de ligando, como cuando hay alteraciones estructurales en los receptores que los activan constitutivamente (como en receptores EGFR truncados). Las células cancerosas pueden también cambiar el tipo de receptores de matriz extracelular (integrinas) que se expresan, favoreciendo los que transmitan señales estimuladoras del crecimiento.
Los mecanismos más complejos que pueden adquirir las células cancerosas
para la autonomía en su crecimiento son alteraciones en los componentes del
circuito citoplasmático de transducción de la señal desde los receptores de GF
y las integrinas. La cascada SOS-Ras-Raf-MAPK tiene un papel central en este
punto; en aproximadamente el 25 % de los tumores humanos, las proteínas Ras
presentan formas estructuralmente alteradas que les permiten actuar sin necesidad
de una señal estimuladora, lo que conduce a una desregulación de las vías de
señalización del crecimiento.
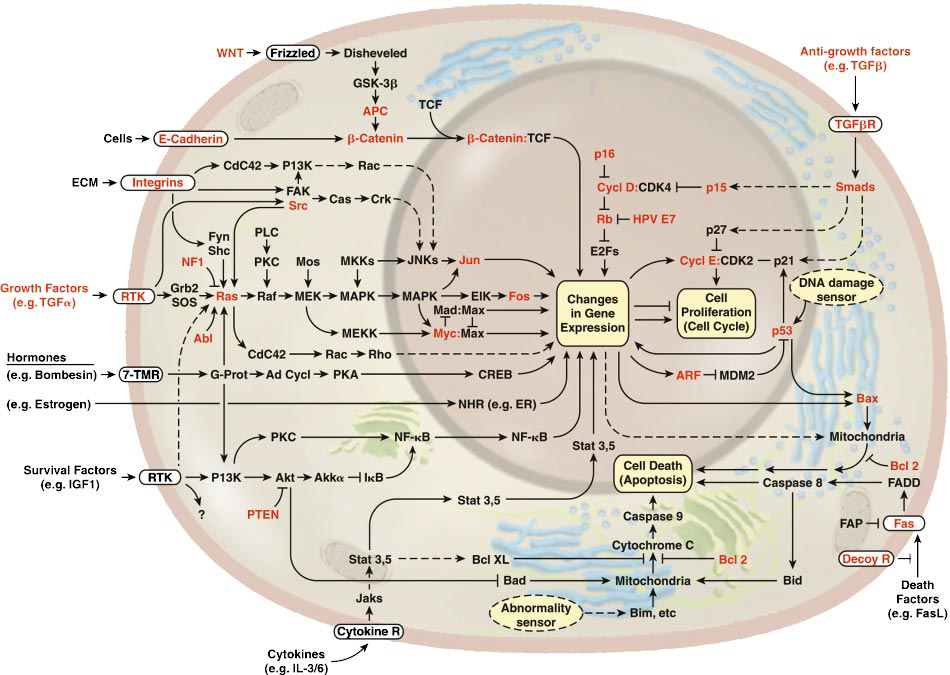
Así, las distintas mutaciones oncogénicas pueden promover la sobreexpresión génica o generar proteínas mutadas cuya actividad esté desregulada. Comúnmente se ven afectados receptores tirosín quinasa de factores de crecimiento como EGFR (el receptor del factor de crecimiento epidérmico), proteínas G como Ras, serín/treonín quinasas como Raf o Akt, tirosín quinasas citosólicas como Src o Abl, quinasas de lípidos como las PI3Ks, receptores nucleares como ER (receptor de estrógenos), componentes de rutas del desarrollo como Hedgehog, Wnt, Hippo o Notch y efectores del ciclo celular como las ciclinas.
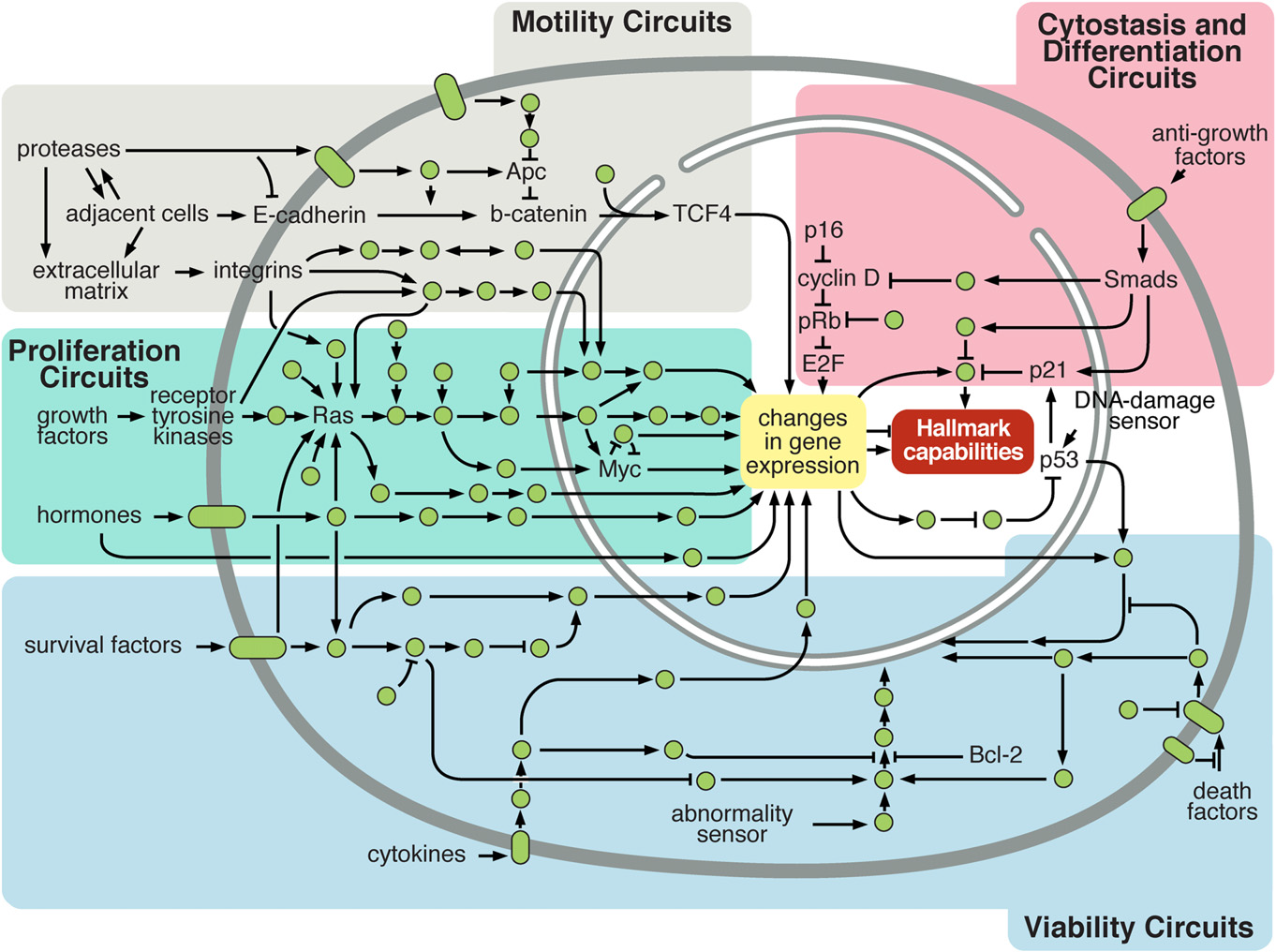
Muchos de los genes mutados más comúnmente son componentes o dianas de las vías de
señalización de PI3K-Akt o de Ras-ERK. Estas vías se suelen activar de manera
transitoria en respuesta a factores de crecimiento, señalización de citoquinas,
integrinas, … pero las alteraciones genéticas pueden provocar su activación
constitutiva. La ruta PI3K-Akt, por ejemplo, puede activarse por mutaciones
activantes o amplificaciones génicas de proteínas que influyen en la ruta,
tales como Akt, PIK3CA (una isoforma de PI3K de tipo I) o la proteína
adaptadora PIK3R1. Lo mismo ocurre en la vía Ras-ERK, en la que se pueden dar
mutaciones activantes en Ras o en Raf, e incluso en zonas de la ruta más
lejanas a su inicio como en Myc.
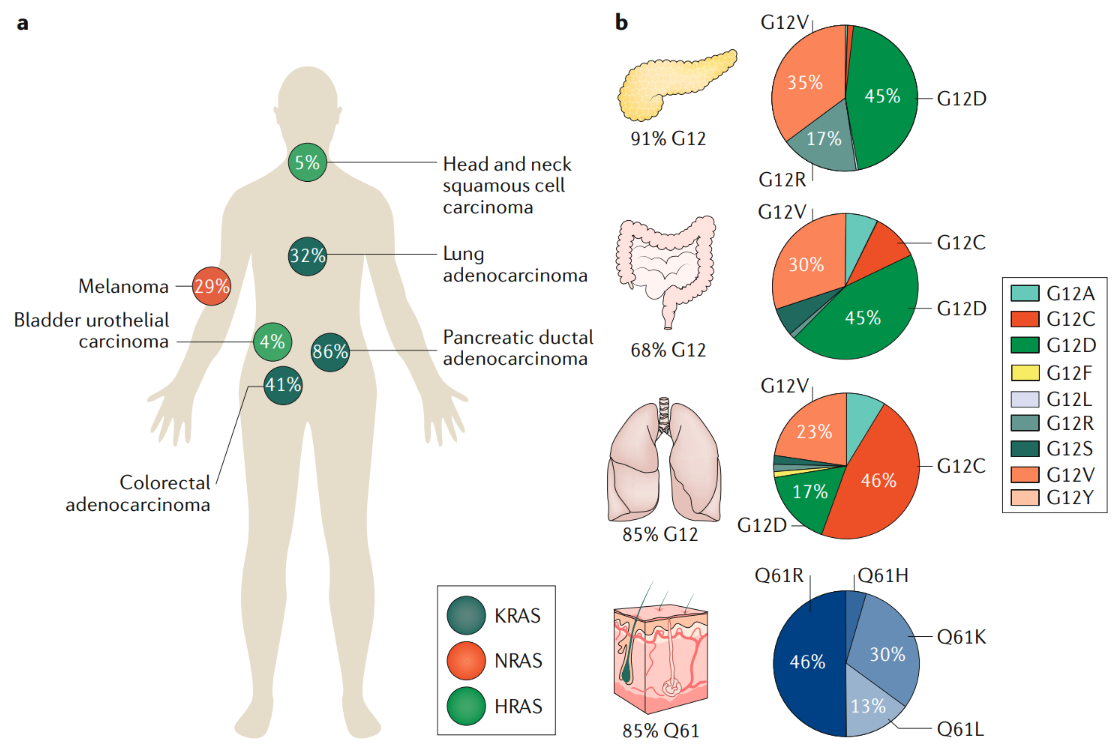
La familia génica RAS (KRAS, NRAS y HRAS) es
una de las más frecuentemente mutadas en cáncer; las mutaciones en KRAS
son conductoras de tres de los canceres más letales: cáncer de pulmón, cáncer
colorrectal y cáncer de páncreas.
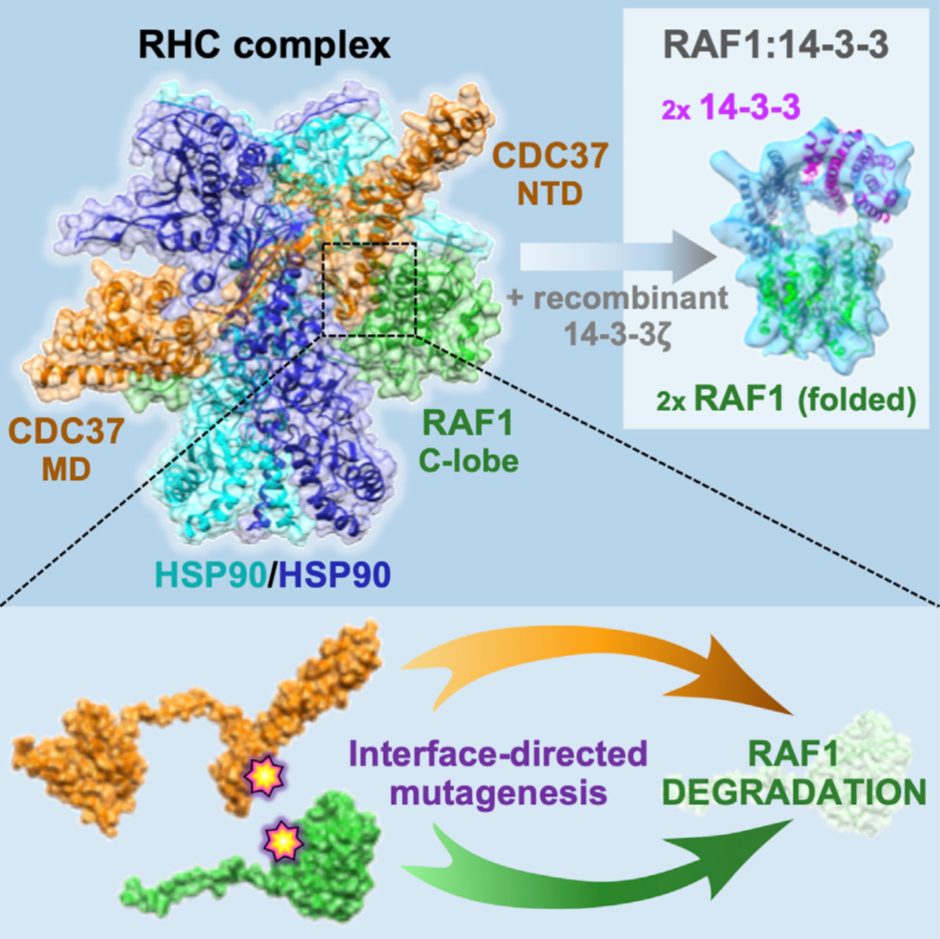
Por esta razón se llevan buscando inhibidores de Ras desde hace décadas, pero son tan difíciles de encontrar que se ha calificado a Ras como undrugguble, es decir, que no es posible usarla como diana terapéutica. Algunas de las aproximaciones actuales para actuar directamente sobre Ras son el uso de inhibidores covalentes que se focalicen en mutaciones concretas como G12C, sobre la que hay en marcha ensayos clínicos con distintos compuestos (como AMG 510), o inhibidores de la interacción Ras-efector. Otras aproximaciones son actuar de forma indirecta, estando enfocadas en otras proteínas implicadas en su ruta de señalización (SOS, SHP2), en el procesamiento de Ras (que requiere de tres pasos de modificación postraduccional), en su oligomerización, etc. Por ejemplo, recientemente se ha revelado una posible diana terapéutica actuando sobre la interacción de RAF1 (una de las isoformas de Raf) con una co-chaperona (CDC37) que permitiría su degradación y, por tanto, la interrupción de la vía de señalización descontrolada.
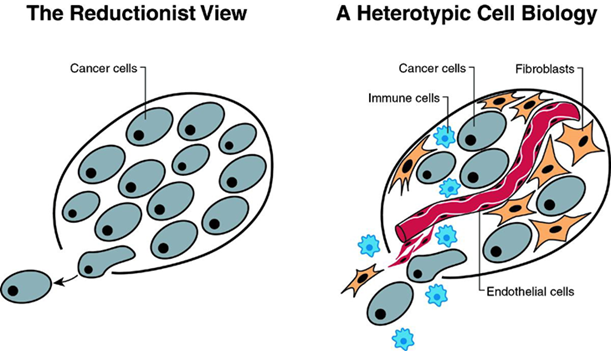
Las propias células del tejido normal (células endoteliales, fibroblastos, …) jugarían un papel esencial en guiar la proliferación tumoral por señales yuxtacrinas, paracrinas e incluso endocrinas (para ver la importancia del microambiente tumoral, pincha aquí). Esta señalización heterotípica entre los distintos tipos células en el tumor sería tan importante para explicar el crecimiento como las propias desregulaciones en las células tumorales. Las células tumorales tendrían la habilidad de cooptar a sus células vecinas para que secretasen abundantes señales de crecimiento. En estos casos, la señalización tanto en Ras-ERK como en PI3K-Akt se vería incrementada.
Todo esto, en su conjunto, conduce a una proliferación celular excesiva. Por ejemplo, desde Ras-ERK se activa Myc (fosforilada por ERK) y estimula la proliferación celular induciendo numerosos genes que la promueven (ciclinas, CDKs, factores de transcripción, …). En la vía PI3K-Akt un ejemplo es el control sobre mTORC1, que promueve la síntesis proteica y es esencial para la progresión del ciclo celular.
Se sabe también que la señalización heterotípica entre los diversos tipos de células dentro de un tumor puede resultar tan importante para explicar la proliferación de células tumorales como los mecanismos autónomos de células cancerosas enumerados anteriormente.
Para saber más:
- Drugging RAS: Know the enemy. Science 355, 6330, 1158-1163 (2017).
- A molecular mechanism for the generation of ligand-dependent differential outputs by the epidermal growth factor receptor. eLife 10:e73218 (2021).
Bibliografía empleada para elaborar el texto y las imágenes:
García-Alonso S, Mesa P, de la Puente Ovejero L, Aizpurua G et al. Structure of the RAF1-HSP90-CDC37 complex reveals the basis of RAF1 regulation. Molecular Cell 82, 18, 3438-3452 (2022).
Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 100, 57-70 (2000).
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 144, 646-674 (2011).
Moore AR, Rosenberg S., McCormick F et al. RAS-targeted therapies: is the undruggable drugged?. Nat Rev Drug Discov 19, 533–552 (2020).
Sever R, Brugge JS. Signal Transduction in Cancer. Cold Spring Harb. Perspect. Med. 5 (2015).